你跟上了吗?这是 35-44 岁人群的平均收入
家庭收入和财富随着年龄的增长而发生显着变化。美联储消费者金融调查的数据显示,家庭的收入和资产通常会在中年时增加。对于35-44岁的家庭来说,这是建立财务实力的关...
2025-11-08
为啥BRCA1和BRCA2的种系突变大概率会导致乳腺癌或卵巢癌,而非其他组织癌变?同样,为啥BRAF突变通常引发的是皮肤癌黑色素瘤嘞?还有,APC突变是结肠癌的标志,VHL基因缺失是肾癌的特征……
在这些大数据得出的结论背后,研究学者留意到,促癌突变似乎仅会在某些特定器官中导致癌变,即癌症相关突变会表现出强烈的组织选择性。
不过,与体细胞突变相比,肿瘤遗传易感基因突变通常与组织特异性癌症风险的相关性更强。然而,这种基因突变如何导致组织特异性癌症表型,仍是癌症生物学中一个悬而未决的问题[1]。
近日,英国剑桥大学的Sakari Vanharanta团队在《自然》杂志上发表了重磅研究成果。
他们通过分析人类肾癌细胞发现,组织特异性癌症表型是谱系转录因子(TF)与基因突变“里应外合”的结果,而且器官特异性转录因子是肿瘤遗传易感基因突变引起组织特异性癌症的关键决定因素[2]。
也就是说,基因突变影响到特异性调控组织细胞生长发育的信号通路时,才有可能引发该组织产生癌变。
例如,在人肾透明细胞癌(ccRCC)中,VHL功能丧失会导致肾脏谱系转录因子PAX8调控的下游致癌信号放大(细胞周期蛋白D1过量表达),加速肾癌细胞增殖。
简单来说,VHL突变恰好影响了特异性调控肾脏细胞生长发育的信号通路,所以才参与了肾透明细胞癌的发生和发展。换做其他的组织器官,细胞的生长发育信号通路不一样,VHL突变就不能发挥促癌作用了。

论文首页
据报道,约90%的ccRCC存在VHL功能丧失性突变,但这一突变在其他癌症类型却较为罕见[3]。
显然,ccRCC这种特殊的基因特征在研究组织特异性癌症表型的工作中具有得天独厚的优势。
之前的研究表明,定义正常细胞状态的转录网络可能对致癌过程至关重要[1],而转录因子(如黑色素瘤中的SOX10)通常是癌细胞生存和增殖所需要的[4]。于是,Vanharanta团队借ccRCC的独特性优势,对组织特异性转录因子如何影响介导下游癌症相关基因改变的致癌表型展开了系统研究。
首先,研究人员以非ccRCC细胞系(MDA-MB-231和HeLa)作为对照,对促进转移性ccRCC细胞系(OS-LM1和786-M1A)增殖的转录因子进行了合并功能缺失筛选。
结果显示,PAX8和HNF1B对ccRCC细胞系表现出很强的特异性。一旦抑制PAX8和HNF1B这两种因子,染色质可及性则会显著降低,特别是远端调节元件。
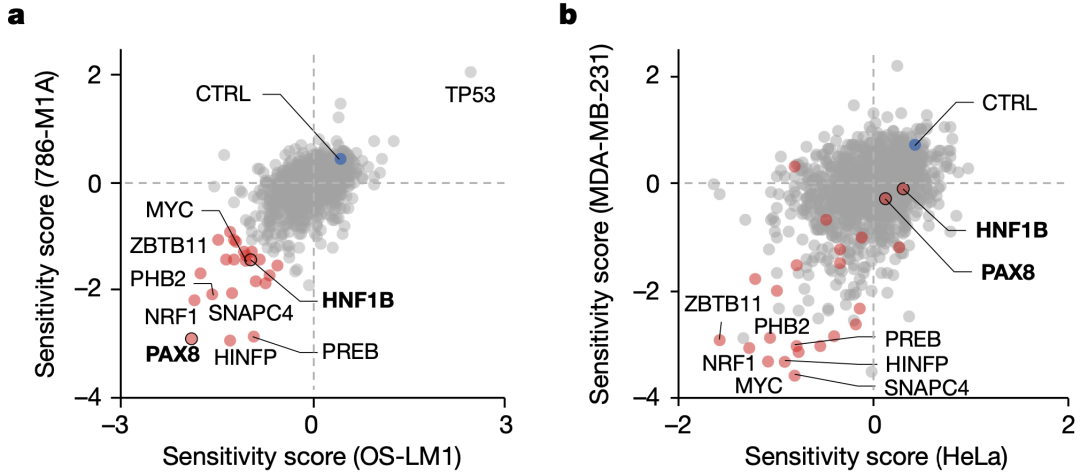
ccRCC细胞系(a)和非ccRCC细胞系(b)的合并功能缺失筛选结果
ccRCC中VHL功能丧失性突变会导致缺氧诱导因子HIF1A和HIF2A的稳定,进而激活下游转录程序,其中HIF2A在ccRCC中起主导作用[5]。因此,研究人员采用内源蛋白的快速免疫沉淀质谱分析(RIME),对HIF2A所占据的核复合物进行了表征。
结果表明,PAX8是HIF2A核相互作用组的成员之一。此外,同时与HIF2A和PAX8组成复合体的蛋白共计99个,其中89个代表性核蛋白在染色质重塑(SWI/SNF复合物)或mRNA加工等过程中发挥作用。

786-M1A细胞中与HIF2A和PAX8相互作用蛋白的RIME测定结果
随后,研究人员对异种移植的ccRCC进行了染色质免疫共沉淀测序分析(ChIP-seq),他们发现,PAX8和HIF2A在染色质上共定位频率相对较高,具体来说,786-M1A和OS-LM1细胞中,分别有43%和65%的HIF2A结合位点上结合了PAX8。
桥豆麻袋,这又是基因组学又是异种移植模型的,想说啥呢?
奇点糕这就为大家总结一下当前的研究结论:ccRCC特异性转录因子PAX8与致癌驱动因子HIF2A在染色质水平上存在相互作用,而且这些相互作用是由DNA和共享的染色质因子复合物介导的。
786-M1A和OS-LM1异种移植肿瘤中,PAX8峰(红色)在所有高置信度染色质开放区域以及HIF2A ChIP-seq峰中的比例
我们接着讲,在上述研究的基础上,研究人员抓住问题中的“主要矛盾”,以HIF2A为突破口来探究PAX8与HIF2A相互作用对肾癌细胞的影响。
为了揪出介导HIF2A驱动ccRCC形成的基因调控元件,研究人员先创建了一个包含706对靶向HIF2A的单导RNA(sgRNA)文库,再将该文库中的sgRNA与dCas9-KRAB共转导进786-M1A细胞中,然后将这些经过特殊改造的细胞接种到15只NSG小鼠身上,待肿瘤形成后,收集肿瘤组织并测定各自的sgRNA水平。
Vanharanta团队发现,共有21个靶向HIF2A结合增强子的sgRNA在肿瘤中耗尽,其中有16个同时与HIF2A和PAX8结合。耗竭最严重的是靶向染色质 11:69,419,632-69,420,080(后文写为E11:69419) 的sgRNA,这个增强子与一个大型临床ATAC-seq癌症数据集中最强的ccRCC特异性开放染色质区域之一重叠,并在ccRCC中被明显激活,而在乳头状RCC中却没有。
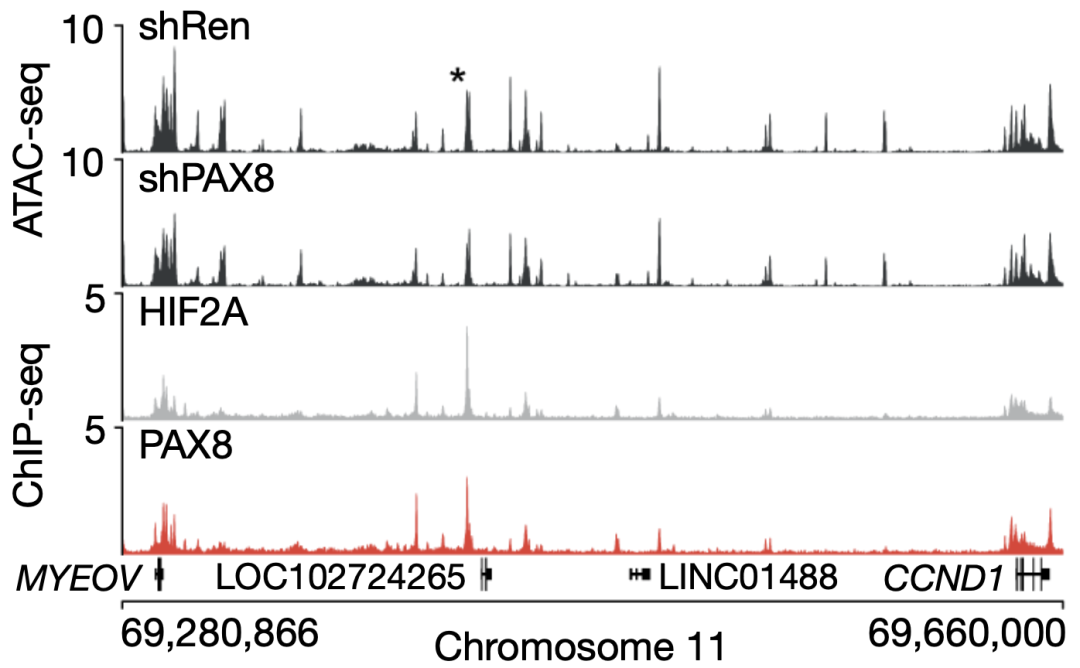
对照组和敲除PAX8的细胞的中位ATAC-seq信号,以及异种移植肿瘤中HIF2A与PAX8的中位ChIP-seq信号(*表示E11:69419)
此外,研究发现增强子E11:69419的两侧是MYEOV和CCND1基因。据报道,CCND1编码的细胞周期蛋白 D1在多种癌症类型中被激活,包括ccRCC,而且其表达受VHL-HIF2A途径调控[6-7]。
于是,研究人员采用短发卡RNA(shRNA)敲除MYEOV和CCND1基因,结果不出所料,这两种基因的敲除能够显著延缓肿瘤进展,而且敲除CCND1的效果更佳。
他们还发现,E11:69419或VHL抑制均会导致MYEOV和CCND1这两种基因表达显著下调。抑制PAX8和HIF2A同样也能降低基因CCND1的表达水平,这说明PAX8和HIF2A可能是调控CCND1表达的上游信号。
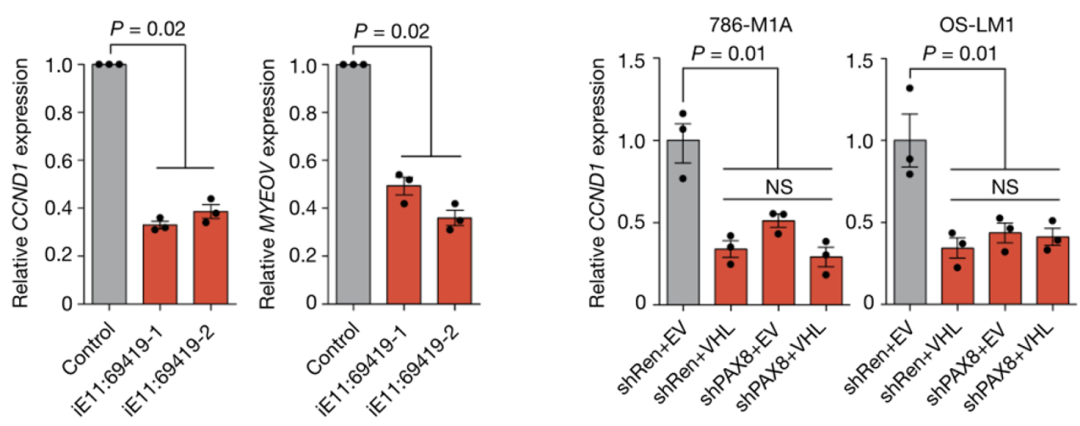
抑制E11:69419、VHL或PAX8后,肾癌细胞中CCND1和MYEOV的表达水平
经过研究分析,Vanharanta团队发现,E11:69419序列中显示的两个假定结合位点是PAX8和HIF2A,而非HNF1B。
这一结果再次印证了PAX8与HIF2A相互作用的结论,并揭示了促成二者相互作用的介质—增强子E11:69419。
此外,他们还发现,敲除PAX8会降低HIF2A在E11:69419上的结合,而敲除HIF2A却不影响E11:69419上PAX8的结合,说明HIF2A在E11:69419上的结合是PAX8依赖性的。
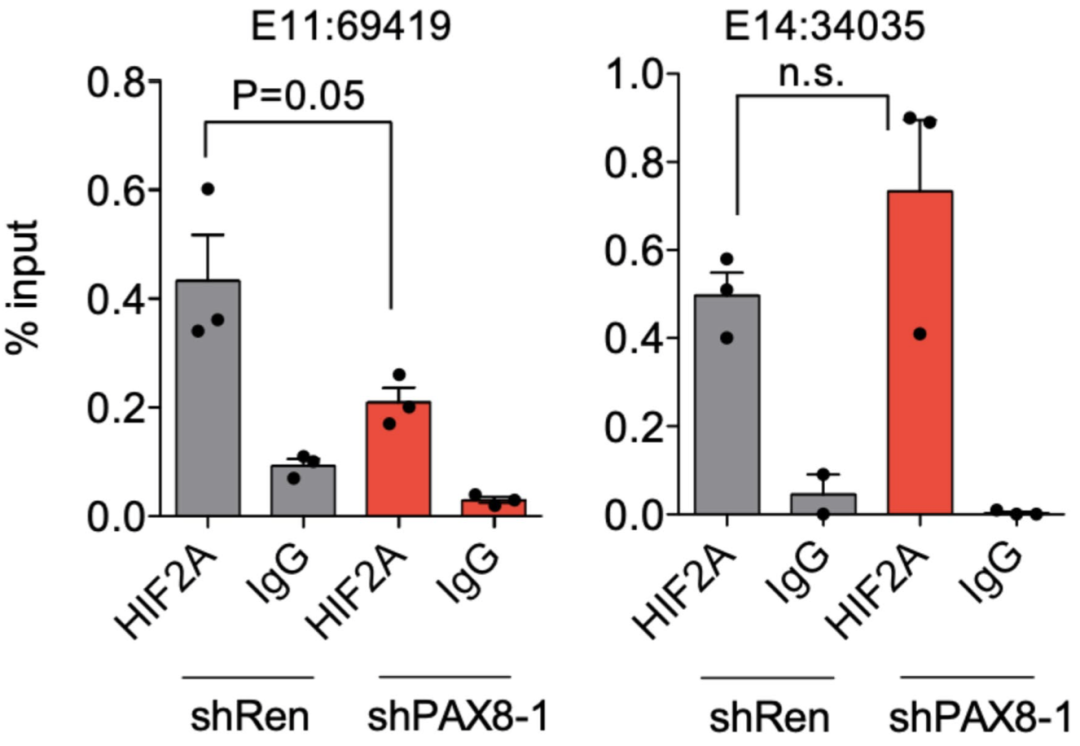
对照组或敲除PAX8的786-M1A 细胞中, E11:69419 以及PAX8非依赖性区域 E14:34035 中HIF2A 抗体或 IgG 的免疫沉淀结果
全基因组关联研究(GWAS)指出,在与人类RCC风险相关的常见遗传变异中,最重要的是染色体11q13.3上的rs7105934,该风险单倍体型包含E11:69419,涵盖了连锁的单核苷酸多态性rs7948643以及rs7939721[8-9]。
与此结论一致的是,研究人员发现,rs7948643正好位于E11:69419序列中PAX8的结合位点,其保护性等位基因C可抑制PAX8的结合,从而降低致癌驱动因子CCND1上游E11:69419的活性。
同时,他们发现,PAX8通过招募HNF1B可以控制MYC表达,而MYC与肾癌向继发部位的扩散相关,这表明PAX8在控制驱动癌症转移方面也有关键作用。
研究至此,我们基本可以推断:肾系转录因子PAX8是导致VHL突变诱发肾癌而非其他癌症的关键因素。
在正常肾细胞中,VHL蛋白会降解HIF2A蛋白,增强子E11:69419上仅结合PAX8,调控细胞周期蛋白D1的表达,从而确保细胞正常增殖。
然而,肾癌细胞中,VHL功能丧失性突变导致HIF2A水平升高,其与PAX8均能结合在增强子E11:69419上,促进细胞周期蛋白D1的表达增加,从而加速肾癌细胞异常增殖。
但也有这么一批幸运儿,他们的E11:69419序列中的rs7948643发生突变,抑制了PAX8结合,也降低了HIF2A的结合,因此,细胞周期蛋白D1表达减少,导致肾癌细胞增殖受限。
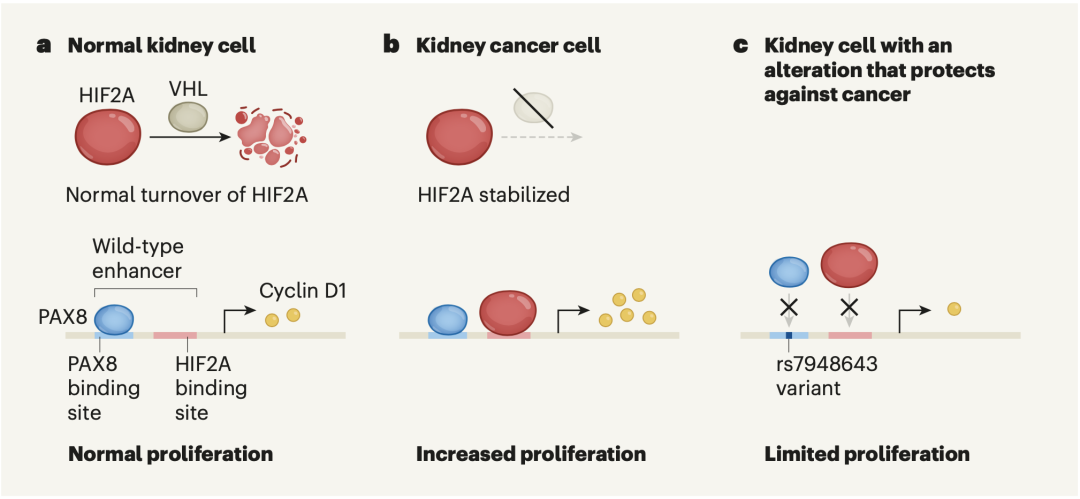
遗传突变与肾癌发展示意图[10]
总的来说,这项研究对决定癌症风险的种系突变和体细胞突变与发育谱系因素之间相互作用的机制提供了深入见解,阐明了PAX8在调控肾癌致癌信号传导中的关键作用,为创造靶向谱系转录因子、实现器官特异性靶向疗法打开了新大门!
版权声明:本文内容由互联网用户自发贡献,本站不拥有所有权,不承担相关法律责任。如果发现本站有涉嫌抄袭的内容,欢迎发送邮件至 78616260@qq.com举报,并提供相关证据,一经查实,本站将立刻删除涉嫌侵权内容。
相关文章
家庭收入和财富随着年龄的增长而发生显着变化。美联储消费者金融调查的数据显示,家庭的收入和资产通常会在中年时增加。对于35-44岁的家庭来说,这是建立财务实力的关...
2025-11-08
实现美国梦现在的成本刚刚超过 500 万美元。这是 Investopedia 为经典美国中产阶级愿望的八大支柱计算的终生家庭价格标签,从拥有住房和退休,到婚礼、...
2025-11-08
对失业和持续价格压力的担忧正在加剧焦虑。密歇根州消费者调查 10 月份对当前经济信心的衡量降至 2022 年 8 月以来的最低水平,当时通胀急剧上升打击了消费者...
2025-11-07
Advanced Micro Devices, Inc.(纳斯达克股票代码:AMD)在本月早些时候宣布与 OpenAI (OPENAI) 建立大规模多...
2025-10-27
最近收到部分没有港卡的宝子想要交易美股入金嘉信或其他美股券商,但是不知道如何入金。其实港美股券商入金方式有很多,每种方式各有优缺点。下面起来总结市面的主流入金方...
2025-10-26
之前两篇入金大家有很多问题,我有看到的也都有逐个解答,另外有些好心的网友也有补充解答,相信大家对嘉信入金有了一定的了解。受人以鱼不如授人以渔,把问的多的问题汇总...
2025-10-26
热评文章
中文财经网
初中生怎样做好学习安排?
如何让自己变得更加优秀
单日新增新冠感染者超百例 安徽怀远发出多份省外协查函
红杉中国再减持美团:持股降至近3%,两年套现已超百亿
让AI更聪明 京东推出最懂产业的AI应用平台言犀2.